– Uten 22.juni-vedtaket hadde vi ikke fått baricitinib godkjent som et behandlingsalternativ før 1. februar 2022. Det vil si at pasienter hvor baricitinib kunne ha vært et alternativ måtte ha ventet et år lenger, sier Karoline Knutsen i Eli Lilly Norge. Illustrasjon: Getty Images
Foto:Rekordraskt Beslutningsforum-ja – takker for 22. juni-vedtaket
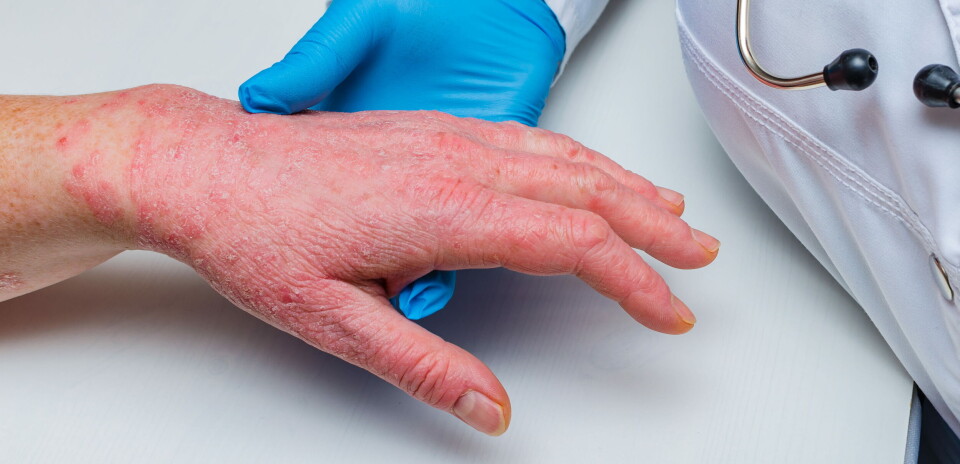
Den biologiske JAK-hemmeren baricitinib (Olumiant) fikk mandag 14. desember godkjent offentlig finansiering av Beslutningsforum som behandling av alvorlig atopisk dermatitt, kun to måneder etter EU-godkjenning.
Denne artikkelen er mer enn fire år gammel.

Mandag 14. desember sa Beslutningsforum ja til innføring av baricitinib til behandling av alvorlig atopisk dermatitt (AD) hos voksne som er aktuelle for systemisk behandling. Legemidlet kan ifølge vedtaket tas i bruk blant norske pasienter fra 1. februar neste år.
– Norge er det første landet i verden til å få godkjent refusjon som følge av innsendt refusjonssøknad, sier Karoline Knutsen, Market Access Manager i Eli Lilly Norge, selskapet bak legemidlet, til Dagens Medisin.
Peker på viktig vedtak
Hun peker på flere viktige momenter som har sikret hurtig behandling av eksempreparatet. Spesielt trekker hun frem det såkalte «22.juni-vedtaket», som tilsa følgende:
«Legemiddel (nytt eller eksisterende) der det allerede finnes faglig likeverdige alternativ innenfor aktuelt bruksområde: Legemiddelet kan tas i bruk rutinemessig selv om det godkjennes etter tilbudsfrist. Det forutsettes at det er sendt inn anbudspris innen tilbudsfrist. Bruk av legemidler som innebærer ny pris i løpet av avtaleperioden, kan eventuelt kun tas i bruk unntaksvis. Unntaksvis bruk av legemidlene skal søkes gjennom allerede eksisterende ordning for unntak i Nye Metoder.
Vedtaket erstattet Beslutningsforums svært omdiskuterte «17.desember-vedtak» fra 2018, som tilsa at «deltakelse i en anbudskonkurranse forutsetter at det foreligger en positiv beslutning om innføring av legemidlet fra Beslutningsforum for nye metoder før tilbudsfristens utløp. Tilbud på legemidler som ikke er besluttet innført ved tilbudsfristens utløp skal avvises. Legemidler (både nye og ved ny indikasjon) som besluttes innført etter tilbudsfrist for en konkurranse vil kunne innlemmes i neste anbudskonkurranse. Legemidlet må vente med å tas i bruk til neste anbud trer i kraft.»
– Uten 22.juni-vedtaket hadde vi ikke fått baricitinib godkjent som et behandlingsalternativ før 1. februar 2022. Det vil si at pasienter hvor baricitinib kunne ha vært et alternativ måtte ha ventet et år lenger. Dette er et godt eksempel på hvor viktig 22-juni vedtaket har vært for tilgangen til legemidler for pasienter i Norge, sier Knutsen.
– Den rake motsetningen
Hun mener den raske beslutningen ved baricitinib for behandling av AD kan også sees i lys av den lengre godkjennelsesprosessen det første biologiske legemiddelet for behandling av AD, dupilumab (Dupixent) fra Sanofi måtte igjennom, der det tok 2 år før pasientene fikk tilgang.
– Det var mye fortvilelse blant pasienter, pasientorganisasjoner og klinikere over den lange prosessen, som var den rake motsetningen av det vi nå har opplevd. På den måten kan man si at første søknadsprosses har gått opp veien for oss.
Roser god dialog med myndighetene
Hun forteller at godkjenningsprosessen startet med tidlig planlegging internt i Lilly, og hun understreker hvor viktig det har vært med en god og tidlig dialog med både Legemiddelverket (SLV) og Sykehusinnkjøp.
– Vi sendte inn dokumentasjon til SLV fire måneder før EMA-godkjenningen og ettersendte også noe nødvendig dokumentasjon underveis i evalueringen. Vi opplevde SLV både imøtekommende og fleksible og jeg tror nok ikke dette hadde gått like raskt uten tett dialog. Parallelt med evalueringsprosessen har vi hatt løpende dialog med Sykehusinnkjøp om anbud, ettersom atopisk dermatitt er nytt i TNF/BIO-anbudet fra 1. februar 2021. Vi startet prisforhandlinger før EU-godkjenningen for at dette skulle gå, sier Knutsen.
















