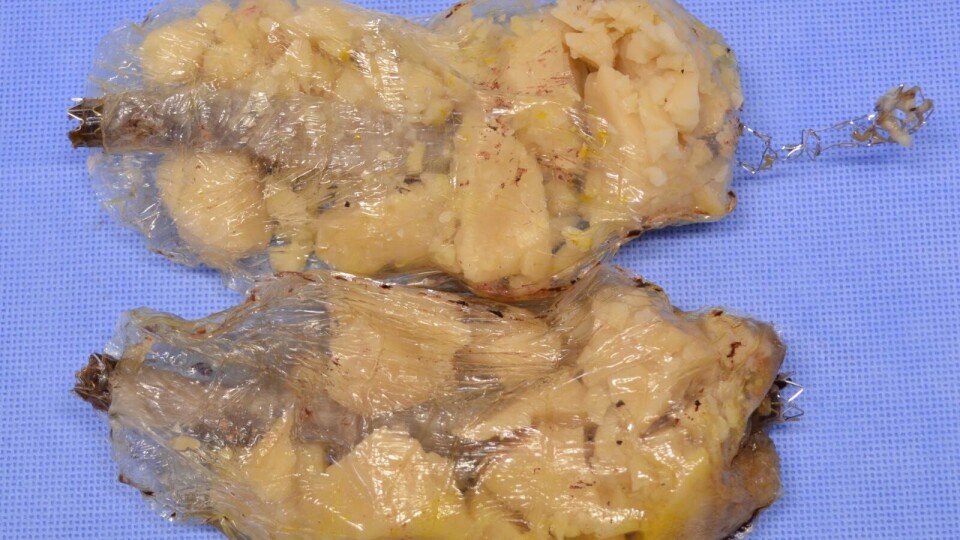
SVIKTET: Nellix var et nytt implantat som ble tatt i bruk på Sykehuset i Hamar i 2013. Det viste seg etter hvert å svikte hos mange av pasientene. Siden den gang har regelverket for medisinsk høyrisikoutstyr som implantater, blitt betydelig skjerpet. Foto: GEPROMED i Strasbourg
Foto:Strengere krav til nye implantater
Et nytt EU-regelverk som kom i fjor, skjerper kravene til klinisk dokumentasjon og strammer inn på flere områder for å sikre implantat-kvaliteten. – Behandlere og pasienter skal være trygge på at implantatet er av god kvalitet, sier enhetsleder Petter Alexander Strømme i SLV.
Denne artikkelen er mer enn to år gammel.
Dagens Medisin har i en rekke saker omtalt hvordan stentgraftet Nellix ble mye brukt ved Sykehuset Innlandet (SI) Hamar, til tross for at det var nytt og utprøvende da det ble tatt i bruk i november 2013.
Helseminister Ingvild Kjerkol sier dette er beklagelig, men hun mener samtidig at det er mindre risiko for at det kunne ha skjedd i dag.
Når det gjelder medisinsk utstyr, har det skjedd store endringer siden implantatet var i bruk i perioden 2013 til 2017.
I mai 2021 kom det et helt nytt EU-regelverk for medisinsk utstyr.
– Dette medfører de største endringene som har skjedd på området på over 30 år. Formålet er å styrke pasientsikkerhet og sørge for trygt og effektivt utstyr, sier Petter Alexander Strømme som er enhetsleder for medisinsk utstyr ved Statens legemiddelverk.
Han forteller at det de senere år har skjedd en rivende teknologisk og vitenskapelig utvikling av medisinsk utstyr, som omsettes for rundt 150 milliarder euro, altså rundt 1580 milliarder kroner, i Europa årlig.
Behandlere og pasienter skal være trygge på at implantatet er av god kvalitet Petter Alexander Strømme, Legemiddelverket
Da EU-kommisjonen begynte arbeidet med det nye regelverket, identifiserte de problemer både når det gjaldt sertifisering av medisinsk utstyr og tilsyn med dem som sertifiserer medisinsk utstyr. Men også når det gjaldt overvåkning av utstyr som allerede er ute på markedet.
I utformingen av det nye regelverket har det vært ekstra oppmerksomhet på sikkerheten ved medisinsk høyrisikoutstyr, som for eksempel implantater, forteller Strømme.
Det nye regelverket skjerper kravene til alle aktører: produsenter, distributører, importører og sertifiseringsorganer.
– Betydelig innstrammet
For å kunne ta medisinsk utstyr til markedet, må det være CE-merket av produsenten. For høyere risikoklasser skal utstyret vurderes av et uavhengig sertifiseringsorgan.

For implantater som regnes som høyrisiko medisinsk utstyr, er det skjerpede krav for å kunne CE-merket utstyret og omsette det på markedet, forteller Strømme.
– Tidligere kunne produsenten som ønsket et nytt implantat ut på markedet, basere seg på ekvivalens, altså kunne de vise til kliniske data fra lignende utstyr. Det er fortsatt en mulighet, men betydelig innstrammet.
Dersom ekvivalens skal legges til grunn, må produsenten ha kontrakt med den andre produsenten og full tilgang til dokumentasjonen for det andre utstyret.
Dersom det ikke er mulig med ekvivalens, må nye implantater gjennom en klinisk utprøving. Hvis studien er i Norge må produsenten søke Legemiddelverket og de etiske komiteene, REK i Norge, før man kan starte klinisk utprøving. Dette er et krav på vei til CE-merkingen.
Strengere kompetansekrav
Det stilles også strengere krav til kompetansen ved sertifiseringsorganene, som må vurdere mange typer høyrisikoutstyr. For eksempel skal personene som skal vurdere et implantat samlet sett ha tilstrekkelig erfaring og kjennskap med den type implantat som skal vurderes, kliniske og tekniske aspekter, forteller Strømme.
Sertifiseringsorganene tar nå i større grad i bruk eksterne eksperter og ekspertpaneler som skal vurdere viktig funksjonalitet ved implantater.
For implantater må sertifiseringsorganene konsultere et uavhengig ekspertpanel satt ned av EU-kommisjonen. Panelet skal gi en vitenskapelig uttalelse om de kliniske dataene for utstyret. Dette er med på å sikre at implantatet er både trygt og effektivt før det CE-merkes og kan selges på markedet, forteller han.
– Også når det gjelder tilsyn med sertifiseringsorganene, som er myndighetenes forlengede arm, er regelverket skjerpet. Det er startet opp felles tilsynsprogrammer på europeisk nivå.
Sikkerhet over tid
Stentgraftet Nellix var et nytt implantat som manglet langtidsdata, og det var nylig blitt CE-godkjent, da det ble tatt i bruk på sykehuset i Hamar i 2013. Etter hvert viste det seg å fungere dårligere enn stentgraft som allerede var i bruk.
– Er det krav om langtidsdata for at nye implantater skal få CE-merking med det nye regelverket?
– Det nye regelverket skjerper kravene til klinisk dokumentasjon, og strammer vesentlig inn på flere områder for å sikre kvaliteten for implantater, svarer enhetslederen.
Han forklarer at dokumentasjonen fra produsenten skal reflektere hvor og hvordan utstyret skal brukes, etter utstyrets tiltenkte formål.
– For implantater skal det være data på sikkerhet over tid for et implantat som skal være i menneskekroppen over tid. Eksakt hva som er tilstrekkelig, blir en vurdering for de uavhengige sertifiseringsorganene.
– Med nytt regelverk stilles det strengere krav til den kliniske kompetansen hos sertifiseringsorganene. Det vil si at de i sin vurdering av utstyret skal involvere klinikere med ekspertise på den aktuelle implantattypen.
Bakgrunn: Sykehuset Innlandet beklager implantat-behandling
– Skal være trygge på god kvalitet
– Fører kravene som i dag stilles for CE-merking av høyrisiko medisinsk utstyr, som implantater, til at behandlere og pasienter kan føle seg trygge på at implantatet er trygt og effektivt?
– Det nye regelverket har ekstra fokus på sikkerheten til høyrisikoutstyr, som medisinske implantater. Det stilles strengere krav til dokumentasjonen og kvaliteten til slikt utstyr. Den kliniske kompetansen hos sertifiseringsorganene skjerpes, og uavhengige EU-ekspertpaneler skal involveres i vurderingen.
Han forklarer at et nytt sporingssystem og implantatkort fra produsent til pasient skal gjøre det mulig å finne pasienten raskt ved feil med utstyret eller dersom det må tilbakekalles. Samlet sett vil dette gjøre implantater mer sikkert.
– Med nytt regelverk skal behandlere og pasienter være trygge på at implantatet er av god kvalitet.
Må følges hele livsløpet
Medisinsk utstyr skal følges nøye også etter at det har kommet på markedet.
– De nye reglene krever at man skal følge det medisinske utstyret gjennom hele livsløpet, og samle inn informasjon om hvordan det fungerer klinisk. Det er en tydelig skjerping av regelverket, sier enhetslederen.
For eksempel plikter produsenter å samle informasjon om klinisk erfaring med utstyret, og sørge for at produktinformasjonen er oppdatert.
Det er også mer åpenhet rundt dokumentasjon når det gjelder høyrisikoutstyr, slik at både brukere og pasienter skal få se dokumentasjonen.
Med det nye regelverket er det også innført implantatkort.
– Hvis du for eksempel får en pacemaker, så skal du nå få utlevert et implantatkort. Der skal det være informasjon om utstyret, LOT-nummer, produsent og slikt. Det skal også vises til en nettside der både behandler og pasient finner informasjon om viktige forholdsregler og sikkerhetsinfo som gjelder implantatet, sier Strømme.
Det er også nye krav om sporbarhet for høyrisiko medisinsk utstyr.
– Helsetjenesten plikter å spore medisinsk utstyr og skal for implantater ha et system for sporbarhet. Det har blitt ytterligere skjerpet med det nye regelverket.
– Er det sannsynlig at de skjerpede kravene til overvåkning etter at implantater tas i bruk, kommer til å sørge for at utfordringer med et implantat – som dem man så med Nellix – avdekkes tidligere på nasjonalt nivå /europeisk nivå?
– Det stilles strengere krav til at produsenten proaktivt skal følge implantatet gjennom hele livsløpet, og samle inn informasjon om hvordan utstyret fungerer klinisk etter at det er plassert på markedet. Dette kan blant annet innebære å identifisere nye risiko, ukjente bieffekter, kontraindikasjoner, og å identifisere mulig off label-bruk av utstyret, svarer Strømme.
– Med nytt regelverk stilles krav til at produsenten utarbeider en plan og rapport for slik overvåking. For høyere risikoklasser skal dette oppdateres minst årlig. Dersom overvåkning av utstyr som er tilgjengelig på markedet, viser at det er behov for forebyggende og/eller korrigerende tiltak, skal produsenten orientere tilsynsmyndighetene og sertifiseringsorganene samtidig, fortsetter han.
Fylkeslegen ba om ny orientering om Nellix-saken: – Risikoen er betydelig mindre for at vi vil se slike saker i Innlandet i fremtiden
– Vi er helt avhengige av sviktmeldinger
Som Dagens Medisin har skrevet, meldte ikke Sykehuset Innlandet fra om dødsfallene knyttet til bruk av implantatet Nellix og metoden EVAS, verken til statsforvalteren, legemiddelverket eller i sykehusets interne avvikssystem. Tre dødsfall ved SI er imidlertid meldt inn til myndighetene av produsenten av Nellix, Endologix.
Helsetjenesten og produsent har alltid hatt plikt til å melde fra om svikt og hendelser knyttet til bruk av medisinsk utstyr, men regelverket er også noe skjerpet på dette området, forteller Strømme.
– Det nye nå er at produsenten også plikter å rapportere om trender man ser ved utstyrets sikkerhet og kvalitet. Ser man noen trender i hendelser over tid, skal man melde om det til myndighetene.
Med trender menes enhver statistisk signifikant økning av hendelser som medfører risiko for helsen og sikkerheten til pasienter og brukere, forteller han.
– Vi er som myndigheter, veldig opptatt av meldinger om svikt og alvorlige hendelser med et medisinsk utstyr. For at vi skal kunne gjøre en god jobb med å følge opp produsenten og myndighetene i landet produktet er produsert, er vi helt avhengig av sviktmeldinger. Dette gjelder både om hendelser som kunne ha skjedd og det som har skjedd.
– Legemiddelverket oppfordrer helsetjenesten til å bruke melde.no, så vi får info om svikt eller hendelser i helsetjenesten.
Han viser til at det internasjonale samarbeidet om medisinske produkter på det europeiske markedet er styrket.
– Det er fri flyt av disse varene i Europa, og det skal være trygt og sikkert for pasientene, både når det gjelder selve produktet og bruken av produktet.
– Det er myndighetene i landet hvor produsenten er etablert og hvor sertifiseringsorganet er etablert som følger opp sakene om svikthåndtering, i tett samarbeid med øvrige myndigheter i det landet produktet er omsatt, sier enhetslederen i SLV til Dagens Medisin.
Les også: Fikk beskjed om å endre implantat-praksis – sykehuset fortsatte behandlingen med Nellix
















