Snur om kreftstudie
Miljødirektoratet har «fremskyndet vurderingene» om den planlagte CAR-T-studien ved Oslo myelomatosesenter.
Denne artikkelen er mer enn fem år gammel.
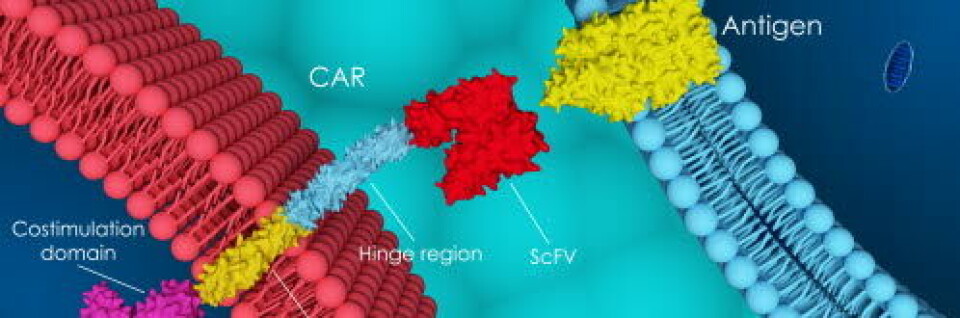
Studien ble satt på vent for 20 norske pasienter, fordi behandlingen måtte godkjennes av Miljødirektoratet.
Årsaken er metoden, der norsk regelverk slår inn:
CAR-T-celleterapi er en behandling der cellene til pasienten manipuleres til å angripe et annet mål. Et nytt gen blir satt inn i T-cellene slik at disse blir i stand til å gjenkjenne og drepe kreftcellene.
Den aktuelle søknaden som Miljødirektoratet fikk levert, var Søknad om utsetting av GMO (genmodifisert organisme), den samme søknaden man bruker når man søker om bruk av genmodifiserte organismer, som for eksempel laks og mais.
Søknaden ble levert i august og svaret som ansvarlig for den norske delen av studien Fredrik Schjesvold fikk, var at Miljødirektoratet trenger 90 dagers behandlingstid. Schjesvold, som er leder for Oslo myelomatosesenter, sa til Dagens Medisin at han mente det hele var en absurd situasjon.
Men Miljødirektoratet kom med følgende uttalelse før helgen:
– Saker som denne har en behandlingsfrist på 90 dager, og første vurdering foreligger normalt etter 45 dager.
– I dette tilfellet har vi registrert at søker er i ferd med å miste den kliniske studien på grunn av lang samlet saksbehandlingstid hos norske myndigheter, og at dette kan ha store konsekvenser for kreftpasienter som ønsker å delta. Derfor har vi fremskyndet vurderingene av hvilke bestemmelser denne kliniske studien faller inn under.
– Konklusjonen er at dette forsøket ikke krever tillatelse til utsetting av GMO. Bakgrunnen er de biologiske egenskapene til legemidlet, spesifikt at det er et menneskes egne celler som blir genmodifisert og tilbakeført. Det er også svært lite sannsynlig at de genmodifiserte cellene vil spres fra pasienten til miljøet, sier Ellen Hambro, direktør i Miljødirektoratet.
– På bakgrunn av søkers opplysninger finner vi at legemidlet er tilstrekkelig fritt for genmodifiserte viruspartikler når det blir tilbakeført til pasienten. Virusene er dessuten ikke formeringsdyktige, heter det fra Miljødirektoratets nettside, og videre:
– Vår vurdering er altså at denne kliniske studien for dette legemiddelet faller inn under lovens bestemmelser om innesluttet bruk av GMO, og at Helsedirektoratet dermed er riktig vedtaksmyndighet, sier Hambro.
– Dette er prinsipielt samme beslutning som Miljødirektoratet kom til i en tilsvarende sak i 2015.
Ifølge Miljødirektoratet debatteres det nå om denne typen kliniske forsøk bør omfattes av reglene for utsetting av GMO, som er de samme som gjelder for planter og dyr som skal settes ut i miljøet, med tilhørende krav om miljørisikovurdering.
Norge er tilsluttet EUs regelverk for GMO. Diskusjoner om slike behandlingsmetoder foregår i flere av EUs medlemsland og på overordnet nivå i EU.